聚焦全球疫情¤|口罩外贸新商机,规避出口风险专业质控少不了
来源:汉斯⌒ 曼集团(HQTS) 2021-07-22

导语

秒懂不同口罩认证标准,减少不必要成本

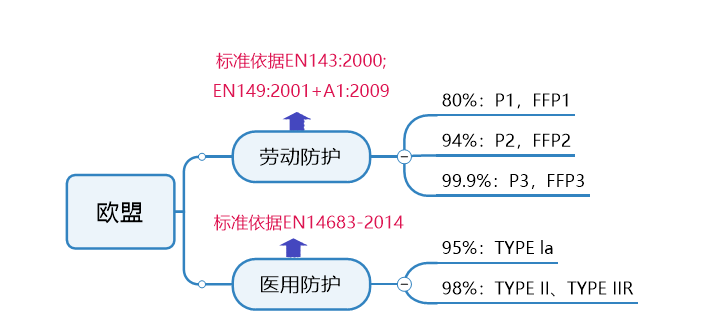

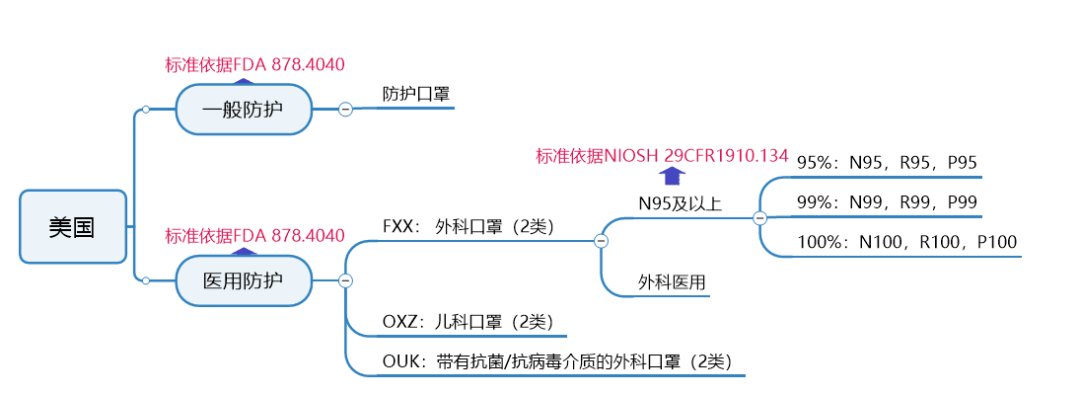

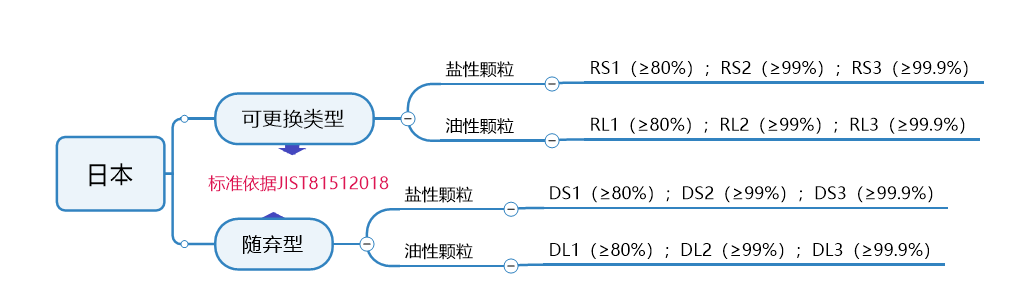

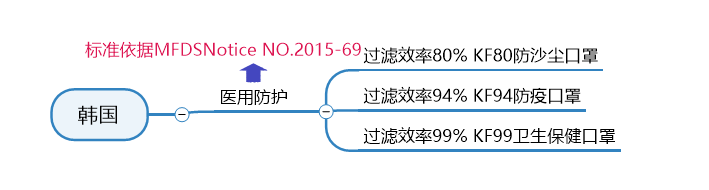

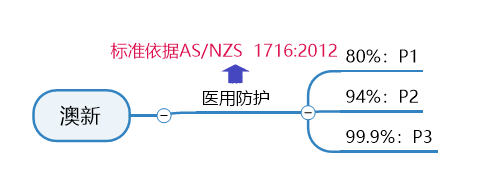

谨防外贸“坑口”,口罩生产质检不能少

HQTS汉斯曼集团为您提供全方位服务
?

专业测评丨红爆全球妈妈圈的德国小红脸补◣铁剂,真的有宣传的那么好吗?
2021-08-19 企业动态
后疫情时①代,食品农√产品大宗贸易风险把控很重要!
2021-08-19 企业动态
后疫情时代,食品农产品大宗贸易风险把控很重要!
2021-08-19 行业资讯
重要提醒:2021年海关对这20类非法检进出口商品进行抽查检验
2021-08-18 行业资讯



